Beschreibung des Produkts
Calmodulin ist ein bioaktives Protein, das aus Rinderhoden isoliert wird. Das Material stammt von individuell gekennzeichneten Tieren, die in Schweden geboren und aufgezogen wurden, einem Land, in dem BSE bisher kein Problem war. Calmodulin ist ein kalziumbindendes Protein, das in vielen eukaryontischen Zellen vorkommt. Durch Bindung an und Regulierung von verschiedenen Proteinzielen beeinflusst es zelluläre Prozesse wie Stoffwechsel, Nervenwachstum, Apoptose, Entzündungen, Muskelkontraktion und Gedächtnis.
Calmodulin wird von vielen Proteinen als Kalziumsensor und Signalübermittler genutzt, da die Proteine selbst nicht in der Lage sind, Kalzium zu binden. Das Molekül kann maximal vier Kalziumionen binden, und durch posttranslationale Modifikationen wie Acetylierung, Phosphorylierung, proteolytische Spaltung und Methylierung können seine Funktionen potenziell verändert werden.
Calmodulin wird als lyophilisiertes weißes Pulver oder Flockulat aus 50 mM NH4HCO3 mit 10 μM CaCl2 geliefert. Es sind keine Konservierungsstoffe zugesetzt.
Nur für den Laborgebrauch.
Anwendungen
- Studien zur Kalziumbindung von Proteinen bei der Regulierung einer Vielzahl verschiedener Zielproteine
- Aktivierung der zyklischen Nukleotid-abhängigen Phosphodiesterase
- Co-Faktor/Aktivator für Kinasestudien
- Studien zum Ödemfaktor-Toxin und zu Anthrax-Bakterien
Gebrauchsanweisung
Lösen Sie das Protein je nach Anwendung in dem gewünschten Puffer auf.
Versand und Lagerung
Mindestens 5 Jahre ab Produktionsdatum stabil, wenn bei -20°C gelagert. Kann bei Raumtemperatur versandt werden. Nach Rekonstitution in PBS pH 7,4 kann die Lösung in Arbeitsaliquots bis zu 12 Monate eingefroren gelagert werden. Wiederholtes Einfrieren und Auftauen wird nicht empfohlen. Falls bei längerer Lagerung eine leichte Trübung auftritt, ist die Lösung vor der Verwendung durch Zentrifugation zu klären.
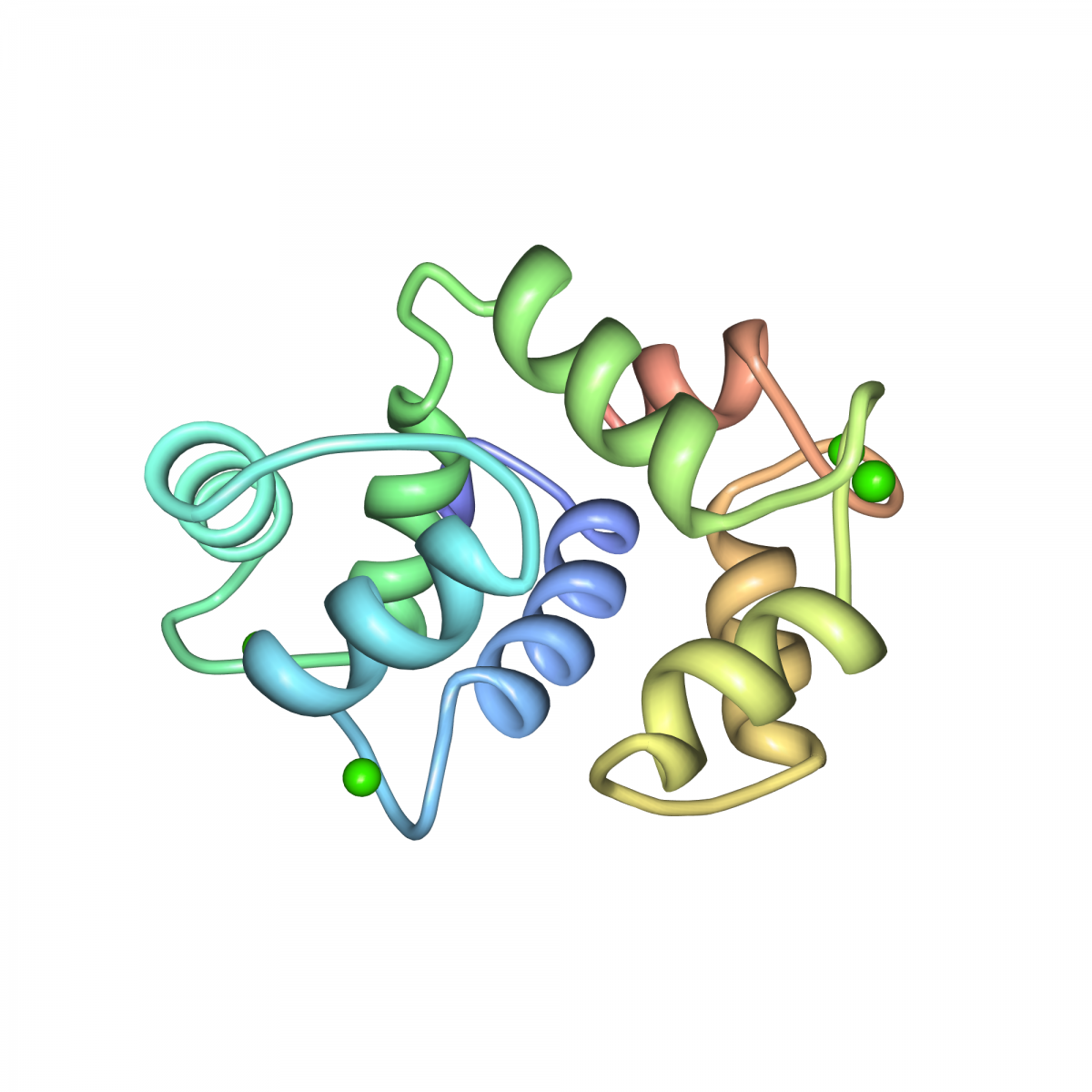
Kristallstruktur von Ca2+-Calmodulin vom Rind (1)
Referenzen
(1) Eine geschlossene kompakte Struktur des nativen Ca(2+)-Calmodulins. Fallon, J.L., Quiocho, F.A.(2003) Struktur 11: 1303 -7